Эффективность скрининга рака предстательной железы
Содержание
Скрининг рака предстательной железы

Целью европейского рандомизированного исследования скрининга рака простаты (ERSPC), проводимого с 1993 г по 2014 г и включающего более 162 000 обследуемых, являлось определение роли регулярного исследования крови на простат-специфический антиген (ПСА) в снижении смертности от рака предстательной железы.
Обследуемые в возрасте от 50 до 74 лет из восьми стран (Бельгия, Финляндия, Франция, Италия, Нидерланды, Испания, Швеция и Швейцария) были рандомизированы на 2 группы: обследуемым в 1-ой группе проводилось скрининговое исследование ПСА каждые 4 года (в Швеции — каждые 2 года), 2-ая группа являлась контрольной (обследование не проводилось). В случае если концентрация ПСА превышала 3 нг/мл, мужчины направлялись на биопсию предстательной железы.
Результаты исследования показали, что в группе с регулярным скринингом смертность от рака предстательной железы в течение 9 лет была ниже на 15% при сравнении с контрольной группой, а в течение 11 лет — на 22%.
При более продолжительном наблюдении дальнейшего увеличения показателей выживаемости в 1-ой группе не выявлено.
Таким образом, смертность от рака простаты среди пациентов, подвергавшихся скрининговому исследованию уровня ПСА, была снижена приблизительно на 1/5 при сравнении с контрольной группой.
Анализ на ПСА: делать или нет
Несмотря на новое свидетельство в пользу эффективности скрининга на ПСА в снижении смертности от рака предстательной железы, остаются сомнения, перевешивают ли преимущества скрининга возможный вред от ассоциированной с ним гипердиагностики. Ученые заключают, что на данный момент стоит воздержаться от введения подобных программ скрининга.
Согласно исследованию профессора Фрица Шредера (Fritz Schröder) из Медицинского центра Университета Erasmus в Нидерландах, являющегося первым автором опубликованной статьи, скрининг ПСА обеспечивает существенное сокращение случаев смерти от рака простаты, с аналогичными или большими показателями, чем при скрининге рака молочной железы. Тем не менее, примерно в 40% случаев скрининга мы имеем дело с гипердиагностикой, приводящей к высокому риску избыточного лечения и побочных эффектов, таких как недержание мочи и импотенция.
Он добавляет: «Время для полноценного скрининга в общей популяции еще не настало. Остро стоит необходимость дальнейших исследований, направленных на снижение гипердиагностики посредством сокращения необязательных биопсий и снижения числа мужчин, которые должны подвергаться скринингу, биопсии и лечению».
Ян Томпсон (Ian Thompson) из Университета Техаса HSC, Сан-Антонио, США и Кэтрин Танжен (Catherine Tangen) из онкологического научного центра Фреда Хатчинсона, Сиэтл, США, обсуждают возможные пути для смягчения недостатков скрининга.
Они считают, что «новые результаты европейского рандомизированного исследования скрининга рака простаты (ERSPC) имеют существенное значение».
Изучение распределения случаев смерти от рака предстательной железы в зависимости от шкалы Глисона и уровня ПСА очень важно для коррекции и адаптации программ скрининга и лечения.
Скринингом рака предстательный железы называется регулярное (1 раз в год или каждые 2 года) обследование у уролога, в ходе которого производится анализ крови на простатоспецифический антиген (ПСА) и пальцевое ректальное обследование.
Проблема скрининга рака предстательной железы очень широко обсуждается во всем мире уже в течение 10 лет. Дело в том, что скрининг рака простаты начал проводиться с конца 80-х – начала 90-х годов.
За эти годы были накоплены как положительные результаты скрининга, так и отрицательные. К положительному результату относится снижение смертности от рака простаты в среднем на 20% во всех развитых западных странах.
К отрицательному результату скрининга рака предстательной железы можно отнести лишние операции у пациентов, которые никогда не умрут от этого заболевания, так как они находятся в той возрастной группе (старше 70 лет), когда наличие у них рака простаты не станет причиной смерти.
Это обычно связано с тем, что рак, который у них выявлен, малоагрессивный и за их жизнь не успеет дать метастазов. Таких больных оперировать не надо.Если говорить о государственных программах скрининга, которые приняты в западноевропейских странах и США, то там обследованию подвергаются большие контингенты мужского населения — более 60 %.
При таких массовых обследованиях там выявляются пациенты, у 70% которых рак находится в ещё излечимой стадии, и у 30% — в неизлечимой. В нашей же стране до сих пор 65-70% выявленного рака предстательной железы — это местно распространенные, либо метастатические стадии, когда больного вылечить уже невозможно.
И очень часто приходится сталкиваться со случаями смерти молодых мужчин, порой моложе 50 лет, от рака предстательной железы.
Поэтому в России говорить о вреде скрининга преждевременно, так как у нас его в должном объеме не было. На Западе если человек включается в государственную программу скрининга, его заболевание со значительно меньшей вероятностью перейдет в неизлечимую стадию, а будет выявлено на ранних стадиях.
В то же время, ему, например, могут провести лишнюю биопсию, и он может подвергнуться ненужному лечению. В любом случае включение в программу скрининга онкологического заболевания – индивидуальное решение пациента.
В Европейском медицинском центре, например, все процедуры проводятся только после получения от пациента информированного согласия, которое он подписывает после получения всеобъемлющей информации о программе от врача.
И мы считаем, что включение мужчин старше 45 лет в программу скрининга рака простаты имеет гораздо больше пользы, чем потенциального вреда и настоятельно рекомендуем это нашим пациентам.
Напоминаем, что в ЕМС действует программа ранней диагностики опасных заболеваний.
Источник: https://www.emcmos.ru/articles/skrining-raka-predstatelnoy-zhelezy
Скрининг и ранняя диагностика рака предстательной железы
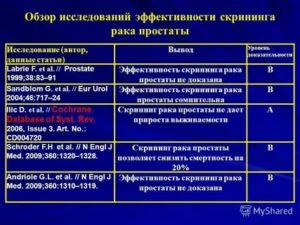
На прошедшем в Копенгагене 16-20 марта 2018 г. ежегодном конгрессе Европейской ассоциации урологии (ЕАУ) была представлена обновленная версия рекомендаций по ведению больных раком простаты. Представляем вашему вниманию обзор данного документа касательно скрининга и ранней диагностики этого заболевания в части определения онкомаркеров.
Популяционный, или массовый, скрининг рака предстательной железы (РПЖ) – это определенная стратегия организации здравоохранения, включающая систематическое обследование клинически бессимптомных мужчин группы риска.
В отличие от него раннее выявление, или оппортунистический скрининг, состоит в проведении индивидуального обследования, которое инициируется самим пациентом и/или его врачом.
Основными задачами обеих скрининговых программ являются снижение смертности вследствие РПЖ и поддержание качества жизни пациентов.
В большинстве западных стран уровень смертности от РПЖ имеет тенденцию к снижению, но масштабы его варьируются. Считается, что снижение этого показателя, наблюдаемое в последнее время в США, в какой-то мере обусловлено принятой политикой интенсивного скрининга РПЖ.
В настоящее время в литературе, посвященной проблемам урологии, вопрос о проведении скрининга РПЖ является одним из наиболее спорных.
Некоторые авторы утверждают, что соблюдение рекомендаций Американской урологической ассоциации или Рабочей группы по профилактике заболеваний США (USPSTF) по проведению скрининга РПЖ может привести к тому, что у значительного числа мужчин агрессивные формы заболевания не будут выявлены. В 2017 г.
USPSTF было опубликовано обновленное положение о том, что мужчины в возрасте 55-69 лет должны быть проинформированы о преимуществах и рисках скринингового определения простат-специфического антигена (ПСА), поскольку таковое ассоциировано с незначительным положительным влиянием на выживаемость. Степень данной рекомендации была повышена до «С» (ранее – «D»).
При сравнении программ систематического и оппортунистического скринингов (Arnsrud Godtman R. et al., 2015) обнаружено, что при организованном обследовании отмечается гипердиагностика и снижение смертности. В то же время в когорте пациентов, прошедших оппортунистический скрининг, наблюдалась еще более высокая частота гипердиагностики при минимальном улучшении выживаемости.Результаты Кокрановского обзора (2013) свидетельствуют о следующем:
- скрининг ассоциирован с повышением частоты диагностирования РПЖ;
- скрининг способствует выявлению в большей степени локализованных форм заболевания и в меньшей – распространенного РПЖ (T3-4, N1, M1);
- согласно результатам пяти рандомизированных клинических исследований (n = 341 000), не обнаружено преимуществ в отношении показателя канцер-специфической выживаемости. По результатам четырех доступных исследований не наблюдалось положительного влияния скрининга на общую выживаемость.
Индивидуализированная тактика ранней диагностики РПЖ с учетом степени риска может быть предложена хорошо информированным мужчинам с прогнозируемой продолжительностью жизни от 10 до 15 лет. Однако этот подход может быть связан с существенным риском гипердиагностики. Поэтому следует тщательно определять когорты пациентов, для которых ранняя диагностика РПЖ наиболее полезна.
К группе повышенного риска развития РПЖ относятся мужчины:
- в возрасте > 50;
- >45 лет с семейным анамнезом РПЖ (по отцовской или материнской линии);
- афро-американцы.
Кроме того, мужчины с уровнем ПСА > 1 нг/мл в возрасте 40 лет и > 2 нг/мл – 60 лет также подвержены повышенному риску метастатического РПЖ или смерти от этой патологии несколько десятилетий спустя.
Информированным мужчинам, подлежащим ранней диагностике РПЖ, следует провести тест на ПСА и пальцевое ректальное исследование.
Стратегия наблюдения за этой категорией пациентов с учетом степени риска разрабатывается на основе исходного уровня ПСА. Оптимальные интервалы между обследованиями не установлены.
Оно может проводиться каждые два года для лиц с изначально повышенным риском РПЖ или откладываться до восьми-десяти лет у тех, кто не подвергается таковому.
На основании данных, полученных Гетеборгской группой Европейского рандомизированного исследования скрининга РПЖ (European Randomized Study of Screening for Prostate Cancer, ERSPC, 2014), сделано предположение, что вопрос о возрасте, в котором следует прекратить раннюю диагностику, остается открытым.
При этом должна быть принята во внимание ожидаемая продолжительность жизни пациента. Мужчинам, у которых прогнозируется меньше, чем пятнадцатилетняя продолжительность жизни, скрининг вряд ли будет полезен.
Кроме того, с учетом отсутствия простого инструмента оценки индивидуальной продолжительности жизни наличие коморбидных состояний столь же значимо, как и возраст.
Рекомендации относительно скрининга и ранней диагностики РПЖ
- Не следует предлагать определение ПСА, не проконсультировав мужчину относительно потенциальных рисков и преимуществ такового (уровень доказательности [УД] 3, сила рекомендаций [СР] сильная).
- Разработать индивидуальную стратегию ранней диагностики с учетом степени риска для хорошо информированных пациентов без тяжелой соматической патологии и с ожидаемой продолжительностью жизни не менее 10-15 лет (УД 3; СР сильная).
- Следует предложить раннее обследование на ПСА хорошо информированным мужчинам группы повышенного риска развития РПЖ (возраст > 50 лет; > 45 лет с семейным анамнезом РПЖ; афро-американцы в возрасте > 45 лет) (УД 2b; СР сильная).
- Предложить стратегию с учетом степени риска (на основе исходного уровня ПСА) с периодом наблюдения 2 года для лиц группы риска (УД 3; СР слабая):
- ПСА > 1 нг/мл в возрасте 40 лет;
- ПСА > 2 нг/мл в возрасте 60 лет.
- Отложить наблюдение до восьми лет у лиц с отсутствием риска.
- Не проводить раннюю диагностику РПЖ, исходя из короткой ожидаемой продолжительности жизни и неблагоприятного статуса здоровья пациента. Мужчинам, у которых прогнозируется продолжительность жизни < 15 лет, скрининг вряд ли будет полезен (УД 3; СР сильная).
Клиническая диагностика
Подозрение на РПЖ обычно возникает, исходя из результатов пальцевого ректального исследования (ПРИ) и определения уровня ПСА.
Окончательный диагноз устанавливают на основании гистопатологической верификации аденокарциномы в биоптатах или образцах ткани простаты после трансуретральной резекции или простатэктомии, проведенных по поводу доброкачественной гиперплазии предстательной железы (ДГПЖ).
Пальцевое ректальное исследование
В большинстве случаев злокачественная опухоль локализуется в периферической зоне простаты и может быть обнаружена методом ПРИ, если объем железы ≥ 0,2 мл.
Положительная прогностическая значимость подозрительных результатов ПРИ у пациентов с уровнем ПСА ≤ 2 нг/мл составляет 5-30%.
Выявление опухоли методом ПРИ связано с риском более высокой степени злокачественности по шкале Глисона и является показанием для биопсии.
Определение уровня ПСА
ПСА является органоспецифическим, но не канцер-специфическим биомаркером, поэтому его уровень может повышаться при ДГПЖ, простатите и других незлокачественных состояниях. Однако уровень ПСА является более достоверным прогностическим фактором рака, чем выявление подозрительных участков посредством ПРИ и трансректального УЗИ.
Для измерения ПСА не существует согласованных стандартов. Это непрерывный параметр, более высокие уровни которого свидетельствуют о более высокой вероятности РПЖ.
Вместе с тем установлено, что многие мужчины могут страдать РПЖ, несмотря на низкий уровень ПСА в сыворотке.
В таблице приведены данные о риске возникновения агрессивного РПЖ (индекс Глисона ≥ 7 баллов) при низких уровнях ПСА.
Плотность ПСА (PSA density, PSA-D)
Этот показатель определяется как количество общего ПСА сыворотки на единицу объема предстательной железы. Чем выше плотность ПСА, тем выше вероятность того, что РПЖ является клинически значимым.
Оценка скорости нарастания и времени удвоения ПСА
Существует два способа измерения динамики уровня ПСА:
- скорость нарастания ПСА (PSA velosity, PSA-V) – это показатель абсолютного ежегодного повышения уровня ПСА в сыворотке крови (нг/мл/год);
- время удвоения ПСА (PSA doubling time, PSA-DT), которое выражает экспоненциальное (величина переменной и скорость ее роста прямо пропорциональны) повышение уровня ПСА в сыворотке с течением времени.
Эти показатели имеют прогностическое значение при проведении лечения РПЖ.
Вместе с тем их использование в диагностике РПЖ ограничено из-за влияния сопутствующих состояний (общий объем предстательной железы, ДГПЖ), разных интервалов между измерениями ПСА и повышения/снижения скорости и времени удвоения ПСА с течением времени. Эти параметры не предоставляют дополнительной прогностической информации по сравнению с определением только уровня ПСА.
Соотношение свободный/общий ПСА (free/total PSA ratio, f/t PSA)
Данный показатель следует использовать с осторожностью, поскольку на его значение могут влиять некоторые методологические и клинические факторы (например нестабильность свободного ПСА при 4 °C и при комнатной температуре; вариабельность характеристик тестов; сопутствующая ДГПЖ).
Тем не менее соотношение свободный/общий ПСА имеет значение при стратификации риска РПЖ у мужчин с общим уровнем ПСА от 4 до 10 нг/мл и нормальным результатом ПРИ. Соотношение свободный/общий ПСА не имеет клинического значения при уровне общего ПСА в сыворотке > 10 нг/мл или при наблюдении пациентов с диагностированным РПЖ.
Дополнительные методы лабораторной диагностики
В настоящее время для исследования доступны панель калликреинов в сыворотке или плазме крови, в т.ч. тест на определение индекса здоровья простаты (уровни свободного и общего ПСА и изоформы -2-про-ПСА), а также четыре маркера калликреина (уровни свободного, интактного, общего ПСА и калликреинподобной пептидазы 2).
Проведение этих тестов может способствовать уменьшению количества ненужных биопсий простаты у пациентов, прошедших исследование ПСА.
В нескольких проспективных мультицентровых исследованиях продемонстрирована более высокая прогностическая значимость индекса здоровья простаты и панели четырех калликреинов в определении клинически значимого РПЖ у пациентов с уровнем ПСА 2-10 нг/мл по сравнению с соотношением свободный/общий ПСА.
Маркер PCA3
Генетический маркер рака простаты 3(Prostate cancer gene 3, PCA3) представляет собой простатспецифическую некодирующую мРНК и измеряется в осадке мочи, полученной после массажа предстательной железы.
На сегодняшний день для определения РСА3 разработана тест-система Progensa.
Этот метод обладает большей по сравнению с ПСА специфичностью и чувствительностью в диагностике РПЖ у мужчин с повышенным уровнем такового.
Величина маркера PCA3 увеличивается в зависимости от объема предстательной железы, однако имеются противоречивые данные о его корреляции со степенью дифференцировки опухоли (по шкале Глисона), и целесообразность его использования при активном наблюдении больных РПЖ пока не доказана. В настоящее время основным показанием для применения теста Progensa является определение необходимости проведения повторной биопсии после получения отрицательных результатов предыдущей (однако клиническая эффективность исследования с этой целью не установлена).Тест SelectMDX аналогичным образом основан на выявлении мРНК в моче. Наличие мРНК генов HOXC6 и DLX1 оценивается с целью определения как риска обнаружения РПЖ при биопсии, так и наличия рака высокого риска.
Рекомендации по определению риска РПЖ у асимптомных пациентов
Во избежание ненужных биопсий асимптомным пациентам с нормальным результатом пальцевого ректального исследования и уровнем ПСА 2-10 нг/мл следует дополнительно оценить риск РПЖ до проведения биопсии простаты. С этой целью используется один из следующих инструментов (УД 3, СР сильная):
- калькулятор риска;
- дополнительное исследование маркеров в сыворотке крови или моче:
- индекс здоровья простаты;
- панель четырех калликреинов;
- РСА3;
- HOXC6/DLX1;
- методы визуализации
Исходя из имеющихся доказательств, некоторые биомаркеры могут способствовать дифференциальной диагностике агрессивных и неагрессивных опухолей в большей мере, чем прогностические параметры, которые в настоящее время используются клиницистами.
Подготовила Виктория Недвиженко
Prostate Cancer. EAU Guidelines. Edn. presented at the EAU Annual Congress Copenhagen 2018. URL:http://uroweb.org/guideline/prostate-cancer/#11
Источник: https://health-kz.com/2019/01/03/skrining-i-rannyaya-diagnostika-raka-predstatelnoy-zhelezyi/
В чем заключается скрининг рака предстательной железы?
Скрининг рака предстательной железы заключается в регулярном измерении уровня простат-специфического антигена (ПСА) в крови у мужчин от 50 до 65-70 лет.
При повышении уровня ПСА выше определенного порогового значения (традиционно это 4 нг/мл) производится т.н. систематическая биопсия предстательной железы под контролем трансректального ультразвукового исследования. При биопсии забираются кусочки ткани простаты, которые исследуются под микроскопом на предмет выявления признаков рака простаты.
У каких мужчин скрининг рака предстательной железы не проводится?
Скрининг рака предстательной железы не проводится у молодых мужчин (до 40 лет), поскольку это заболевания в таком возрасте практически не встречается. В возрасте от 40 до 50 лет рак предстательной железы выявляется также редко, кроме случаев с наследственной предрасположенностью.
Поэтому в данном возрастном промежутке скрининг показан только при наличии рака простаты у близкого родственника пациента.
У пожилых мужчин и мужчин с тяжелыми неизлечимыми заболеваниями, у которых вероятность прожить 10 лет и более невелика, скрининг может приносить больше вреда, чем пользы, поскольку выявление и лечение начальных форм рака предстательной железы никак не скажется на продолжительности жизни, но может ухудшить ее качество.
При помощи каких методов можно выявить рак предстательной железы?
Традиционно рак предстательной железы диагностировался при помощи пальпации простаты через прямую кишку. К сожалению, этот простой метод может выявить опухоль только в том случае, когда она достаточно большая и часто уже не подлежит радикальному лечению.
Поэтому, чтобы выявить опухоль на раннем этапе, когда она еще не пальпируется, требуется выполнить так называемую биопсию, которая заключается в заборе кусочков ткани простаты специальной иглой из определенных зон железы.
Чтобы не пропустить опухоль требуется выполнить от 6 до 10 (иногда и более) биопсий. Такая биопсия называется систематической и выполняется под контролем трансректального ультразвукового исследования. Обычно биопсия выполняется не всем мужчинам, а только тем, у которых имеется повышение уровня ПСА в крови.
Что такое Простат-специфический антиген (ПСА)
ПСА (простат-специфический антиген) – это опухолевый маркер рака предстательной железы. ПСА представляет собой белок, который вырабатывается исключительно в предстательной железе и в минимальных концентрациях попадает в кровь. При раке предстательной железы обычно в кровь попадает большее количество ПСА, что используется для раннего выявления этого заболевания.
Тем не менее, у такой методики имеется существенный недостаток, который заключается в том, что повышение уровня ПСА часто бывает при других, доброкачественных заболеваниях простаты (например, воспаление простаты или доброкачественная гиперплазия предстательной железы).
При помощи каких методов можно «увидеть» рак предстательной железы?
Несмотря на то, что болевые ощущения при биопсии можно значительно уменьшить, используя местную анестезию, многие мужчины опасаются этой процедуры и интересуются, нельзя ли каким либо образом «увидеть» (или визуализировать) рак, чтобы выполнять биопсию более избирательно. К сожалению, при помощи простых методов, например, трансректального ультразвукового исследования, надежно выявить рак предстательной железы нельзя.
Использование магнитно-резонансной томографии (МРТ)
Перспективным является использование магнитно-резонансной томографии (МРТ) в определенных режимах, однако это пока является предметом научных исследований.
Есть ли недостатки скрининга рака предстательной железы?
Да, как и у любого скрининга, они имеются. Так, в ходе скрининга можно выявить так называемый «незначимый» рак, который в отсутствие скрининга никогда бы не был выявлен (а значит и пролечен). А «ненужное» лечение в таких случаях может приводить к осложнениям и стойким последствиям.
Кроме того из-за неспецифичности ПСА рак выявляется только у 20-30 % из числа мужчин с повышенным уровнем этого маркера, а значит оказывается, что биопсия не нужна большинству пациентов, которым она проводится.
Нужен ли скрининг рака предстательной железы?
В настоящее время западные ученые ведут дискуссии о необходимости скрининга рака предстательной железы, поскольку у ученых нет твердой уверенности, что польза от скрининга превышает его потенциальные недостатки. Что касается нашей страны, то в настоящее время ведется изучение вопроса о необходимости внедрения скрининга.
Тем не менее, внедрение в Беларуси элементов скрининга в форме так называемого «раннего выявления» принесло бы несомненную пользу, учитывая частое выявление этого заболевания в далеко зашедшей стадии.
Что надо знать о скрининге рака предстательной железы?
Если у Вас в семье были случаи рака предстательной железы у кровных родственников или Вы ответственно относитесь к своему здоровью и хотели бы принять участие в программе раннего выявления рака простаты, несмотря на возможные неудобства, обратитесь к своему урологу для выполнения исследования уровня ПСА в крови.
Помните, что только профессионально выполненная биопсия предстательной железы (а иногда несколько биопсий) может исключить наличие рака предстательной железы при повышенном уровне ПСА.
Ультразвуковое исследование с эластографией сдвиговой волны и мультипараметрическая магнитно-резонансная томография при заболеваниях предстательной железы
В современной онкоурологии актуальность проблемы заболевания раком предстательной железы обусловлена широкой распространенностью данной патологии и лидирующим местом в структуре онкологической заболеваемости мужчин большинства стран мира. По данным Белорусского канцер-регистра в структуре заболеваемости злокачественными новообразованиями мужчин предстательная железа занимает первое место.
Существующие стандартные методы диагностики злокачественных опухолей предстательной железы обладают высокой точностью при выявлении заболевания. В РНПЦ ОМР им.Н.Н.
Александрова используются и новые методы исследования, позволяющие улучшить стандартный подход на основе применения трансректального ультразвукового исследования с эластографией сдвиговой волны, которая открыла новые возможности количественной оценки жесткости ткани и позволяет определить локализацию подозрительных очагов.
Для подтверждения или исключения наличия злокачественной опухоли предстательной железы выполняется биопсия под контролем трансректального ультразвукового исследования.
Она состоит из целевого этапа получения материала из подозрительных очагов, которые выявлены при помощи мультипараметрической МРТ таза и трансректального УЗИ с эластографией сдвиговой волны (т.к.
точность определения диагноза возрастает, когда биопсия ориентирована на более жесткие области) и рекомендуется в сочетании с систематическим многоточечным этапом по определенной схеме.
Эластография показывает преимущества при выявлении в области верхушки и средней части простаты, тогда как МРТ – в визуализации базальной и переходной зон.
На рисунке представлен клинический пример пациента с повышенным уровнем ПСА. Ему выполнены мультипараметическая МРТ и трансректальное УЗИ с эластографией сдвиговой волны по данным которых определялись подозрительные очаги (указано стрелками или красным цветом).В последующем выполнена биопсии предстательной железы, которая состояла из систематического и целевого этапов. По результатам биопсии установлен диагноз рак предстательной железы с суммой баллов Глисона 4+3 (ISUP Grade 3).
Пациенту выполнена радикальная простатэктомия в результатах которой подтвердилась правильно установленная стадия и лечение проведено успешно.
Установившийся тренд на изменение подходов к методике выполнения биопсии предстательной железы с включением целевого этапа при проведении систематической биопсии является результатом определенных успехов развития методов лучевой диагностики, в частности совместного использования при планировании биопсии результатов мультипараметрической МРТ и трансректального УЗИ с эластографией сдвиговой волны.
Источник: https://omr.by/spetsialistam/skrining/skrining-raka-predstatelnoj-zhelezi
Всегда ли злокачественный процесс в предстательной железе приводит к повышению уровня ПСА?
Некоторые виды опухолей предстательной железы, особенно, быстрорастущие, могут не вызывать повышения уровня ПСА. В таком случае, напротив, речь идёт о «ложноотрицательных» результатах. В связи с такой неоднозначностью результатов данного исследования, крайне важно иметь дело с квалифицированным специалистом, опыт и знания которого позволяют правильно оценить ситуацию.
Каковы преимущества проведения исследования крови на ПСА?
Ранняя диагностика некоторых видов рака предстательной железы может иметь решающее значение. Повышенный уровень ПСА может служить индикатором опухоли предстательной железы, способной распространяться на другие органы (метастазировать) или быстрорастущей опухоли, могущей вызвать другие проблемы.
Своевременное начало лечения может помочь остановить процесс, пока он не стал причиной развития серьёзных симптомов. В некоторых случаях, начало лечения на более ранних стадиях означает менее агрессивную терапию, что значительно снижает риск развития нежелательных побочных явлений, таких как эректильная дисфункция или недержание мочи.
Есть ли недостатки у ПСА-скрининга?
Скрининг и ранняя диагностика
Рак предстательной железы является второй лидирующей причиной смертности среди мужчин. Как и в случае с другими видами рака, раннее выявление увеличивает шанс излечения заболевания; пока еще не ясно, снижает ли скрининг рака простаты количество летальных исходов от этого заболевания.
Часто после постановки диагноза рака предстательной железы врачи и пациенты выбирают курс «настороженного ожидания», а не начала лечения.
Несмотря на разногласия, все еще рекомендуется, чтобы мужчины проходили ежегодный скрининг на выявление этого заболевания с использованием пальцевого исследования прямой кишки, анализа крови на простат-специфический антиген (ПСА) и трансректального ультразвукового исследования.
Сейчас рекомендуется, чтобы мужчины начинали скрининг с применением ПСА в 50 лет, а мужчины-афроамериканцы и мужчины с наследственной предрасположенностью к раку простаты начинали проходить ежегодный скрининг в возрасте 45 лет.
Пальцевое исследование прямой кишки. При пальцевом исследовании прямой кишки врач вводит палец в перчатке в прямую кишку с целью оценки структуры ткани и размера простаты.
Этот метод на протяжении многих лет является наиболее распространенной процедурой скрининга предстательной железы; однако предстоит еще определить, является ли этот метод эффективным в снижении количества летальных исходов от рака простаты.
Анализ крови на простат-специфический антиген (ПСА). Простой анализ крови позволяет лаборантам определить уровни ПСА — белка, вырабатываемого и распределяемого предстательной железой. Высокие уровни ПСА могут указывать на наличие раковых клеток предстательной железы или на другие нераковые состояния простаты.
Трансректальное ультразвуковое исследованиеподразумевает введение в прямую кишку небольшого зонда, излучающего высокочастотные звуковые волны, которые отражаются от предстательной железы и вызывают формирование визуального эха.
Компьютер использует эхо для создания картинки, называемой сонограммой, которая позволяет выявить патологические зоны. Ученым еще предстоит выяснить, эффективно ли трансректальное ультразвуковое исследование в снижении количества летальных исходов от рака простаты.Хотя сегодняшние рекомендации по скринингу являются стандартными, некоторые исследования показывают, что более ранний поиск предикторов рака предстательной железы может быть более эффективным.
Недавно ученые провели исследование с применением специальной компьютерной программной обработки для того, чтобы определить, сколько жизней можно было бы спасти, используя тест на ПСА в каждом из семи различных случаев.
Исследователи выявили, что наиболее эффективной стратегией является начало проведения тестирования на ПСА в возрасте 40 лет, повторение теста в 45 и 50 лет и прохождение теста в последующем каждые два года.
Исследователи продолжают развивать и совершенствовать лабораторные тесты с целью улучшения специфичности теста на ПСА. Более специфические результаты тестов на ПСА могут способствовать устранению дальнейших инвазивных процедур, снятию обеспокоенности и сокращению медицинских затрат пациентов с повышенными уровнями ПСА с доброкачественным состоянием.
Специфические антигены простаты могут быть обнаружены в различной форме в крови, что может создать трудности для интерпретации. Специфические антигены простаты могут быть связаны с различными молекулами в крови или существовать как изолированные «свободные» протеины.
Ингибитор протеазы α1 представляет собой один из специфических белков, связанный, в основном, с ПСА в крови. Предыдущие исследования показали, что соотношение свободных ПСА к общему количеству ПСА увеличивает точность выявления рака простаты.
С целью дальнейшего получения специфичности тестирования на ПСА ученые недавно разработали анализ крови, позволяющий обнаружить наличие ингибитора протеазы α1, связанного с ПСА.
Инсулиноподобный фактор роста (ИФР-1) и инсулиноподобный фактор роста связывающий протеин 3 (ИФР-СП-3) могут помочь отличить доброкачественную гиперплазию предстательной железы от рака предстательной железы.
Повышенные уровни ИФР-1 и ИФР-СП-3 у мужчин с низкими и средними уровнями ПСА предупреждают о раке простаты. Отношение ИФР-1 и ИФР-СП-3 к свободным ПСА стоит выше, чем применяемое сейчас соотношение «свободный/общий» ПСА в распознавании доброкачественной гиперплазии предстательной железы и рака предстательной железы.
Предиктивное генетическое тестирование. Исследователи недавно идентифицировали генетическую альтерацию, увеличивающую риск заболевания раком предстательной железы.
Существует 4 различных альтерации гена наследственного рака простаты 2 (НРП2), наличие которых указывает на средний или высокий уровень риска заболевания раком простаты у мужчин. Хотя ученые еще не понимают, каким образом альтерации НРП2 влияют на последующее развитие рака простаты, они продолжают исследовать свойства и характеристики этого гена.
Поскольку вопросы по динамике этого гена все еще открыты, более точная информация могла бы внести свой вклад в развитие предиктивного генетического тестирования и, возможно, в создание даже новых лекарственных препаратов от рака простаты, которые будут направлены исключительно на эту генетическую альтерацию.
Хотя индентификация НРП2 является перспективной, требуются дополнительные исследования, прежде чем тестирование НРП2 станет доступным в клинической практике.С 1994 г. изучается связь между геном GSTP1 и раком простаты. В своем недавнем клиническом исследовании ученые оценили точность уровней метилирования гена GSTP1 в прогнозировании наличия рака простаты.
Ученые обследовали удаленные хирургическим путем ткани простаты 69 пациентов с локализованным раком простаты и 31 пациента с доброкачественной гиперплазией предстательной железы. 28 из 69 пациентов с локализованным раком простаты также имели предраковые ткани, которые были изучены.
Среднее соотношение метилированных генов GSTP1 к контрольному гену в других образцах тканей составило 0 для ткани с доброкачественной гиперплазией предстательной железы, 1,4 для предраковой ткани и 250,8 для клинически локализованного рака предстательной железы.
Ученые также проанализировали эффективность измерения метилирования гена GSTP1 при постановке диагноза рака простаты в небольших образцах-биоптатах. Для этого клинического исследования соотношение метилированного гена GSTP1 к контрольному гену было измерено в небольших образцах-биоптатах, взятых у 21 пациента с высоким уровнем ПСА.
Из всех пациентов 10 пациентам был поставлен правильный диагноз об отсутствии рака простаты, а 10 из 11 был поставлен правильный диагноз рака простаты с использованием соотношения GSPT1. Эти результаты вселяют надежду и показывают, что измерение метилирования GSTP1 может быть использовано для повышения точности выявления ранней стадии рака предстательной железы.
Источник: https://prostatitnik.ru/skrining-raka-predstatelnoy-zh/
Ранняя диагностика рака предстательной железы — шанс на излечение

Рак предстательной железы (РПЖ) все больше привлекает внимание онкологов. Заболеваемость им стремительно растет, особенно среди пожилых мужчин. Эта локализация рака занимает 2–3 место по частоте среди впервые выявляемых онкологических диагнозов в развитых странах.
По причинам смертности у мужчин РПЖ – на втором месте после рака легкого. Несмотря на внедряемый скрининг, около 50% впервые установленных карцином простаты — это третья и четвертая стадия.
РПЖ, выявленный на ранней стадии, в 90% полностью излечивается, что обуславливает необходимость своевременного обследования.
Диагностика рака предстательной железы: группа риска
Мужчины старше 50 лет должны помнить об этом заболевании. Посетить врача рекомендуется при наличии следующих симптомов:
- учащенное мочеиспускание, особенно подозрительны подъемы в туалет в ночное время; затруднение акта мочеиспускания;
- изменения самого процесса мочеиспускания: ослабление или разбрызгивание струи, чувство неудовлетворенности после посещения туалета, неполное опорожнение пузыря;
- ослабление потенции; примесь крови в сперме или моче.
Симптомы эти неспецифические, они встречаются и при доброкачественной гиперплазии, которая также выявляется после 50-60 лет. Тем не менее риск заболеть раком ПЖ присутствует у трети мужчин пожилого возраста.
Проверяться должны мужчины и без признаков патологии, так как на раннем этапе развития РПЖ может никак себя не проявлять. Рекомендовано проходить осмотр у уролога лицам старше 50 лет 1 раз в 2 года.
Люди, кровные родственники которых больны РПЖ, более подвержены развитию карциномы, т.к. предрасполагающая наследственность является фактором риска развития этой опухоли. Шанс заболеть раком ПЖ в 2–3 раза выше у мужчин, у кого в семье по мужской линии (отец, брат) установлен данный диагноз. Если же РПЖ диагностирован у двух родственников, риск увеличивается до 8 раз.
Скрининг
Скринингом называется массовое обследование лиц группы риска с целью выявления бессимптомной патологии. Так как рак простаты на начальных этапах чаще всего не проявляется, очень важно найти методы его раннего выявления.
В отношении РПЖ скринингом считается пальцевое исследование простаты и определение показателя ПСА (простатспецифического антигена) в крови.
В существующем, на настоящий момент, в России порядке прохождения диспансеризации взрослого населения предусмотрено определение общего ПСА в возрасте 45 и 51 года.
При выявлении отклонений от нормы – консультация хирурга или уролога. Сроки, периодичность и обязательность обследования для всех мужчин в настоящее время пересматриваются.Скрининг имеет свои недостатки, многие ученые высказываются за добровольное и индивидуальное принятие решения в этом вопросе.
Пальцевое ректальное исследование (ПРИ)
Простата хорошо прощупывается через стенку прямой кишки. Метод простой, доступный, проводят его как урологи, так и обычные хирурги. Но таким способом выявляются только опухоли, расположенные в задней периферической зоне.
В норме железа эластической консистенции, размером примерно с грецкий орех, податлива при надавливании, симметрична, с ровными контурами. Слизистая прямой кишки над ней подвижна.
При пальпации врач обращает внимание на:
- очаговые образования (бугристость поверхности);
- асимметрию железы; нечеткость контуров;
- неподвижность простаты при давлении на нее;
- наличие тяжей инфильтрата по верхнему краю железы;
- в запущенных случаях – большая опухоль, очень плотной консистенции, далеко выступающая в просвет кишки.
Наличие хотя бы одного пальпируемого признака должно стать сигналом к дальнейшему обследованию. Однако этот метод мало информативен и не подходит для скрининга. Эффективность ранней диагностики рака предстательной железы при пальпации через прямую кишку не превышает 4%.
Лабораторные критерии
- Общий анализ крови. На начальных этапах — неинформативен, т.к. показатели остаются в пределах референтных значений. На поздних стадиях определяется анемия, лейкоцитоз, увеличение СОЭ.
- Анализ мочи – возможна макро- и микрогематурия (наличие крови), протеинурия(белок в моче), определение избыточного количества лейкоцитов.
- Уровень ПСА.
Пса как маркер диагностики рпж
ПСА – гликопротеин, вырабатываемый секреторным эпителием простаты. Это тканевой белок, его количество повышается в крови не только при карциномах, но и при доброкачественной аденоме и хронических воспалительных процессах.
Различные манипуляции (массаж простаты, катетеризация мочевого пузыря, пальцевое ректальное исследование) увеличивают концентрацию ПСА на несколько дней, а инвазивные вмешательства (биопсия, трансуретральная резекция) – на несколько недель.
На этот анализ может влиять прием алкоголя и предшествующий половой акт.
Средним нормальным считается уровень 2,5 нг/мл. С возрастом референтные значения расширяются. У лиц старше 70 лет содержание ПСА до 6,5 нг/мл не считается патологией.
ПСА в крови находится как в свободном, так и в связанном с белками состоянии. Сумма этих двух фракций и составляет цифру общего ПСА.
Считается, что повышение данного показателя до 10 нг/мл чаще связано с ДГПЖ, а при цифре > 10 нг/мл – более вероятен РПЖ. В целом чем выше уровень ПСА, тем чаще выявляется карцинома простаты. В то же время у 13% мужчин с верифицированной карциномой уровень ПСА был в норме.
Однократное впервые выявленное повышение этого показателя не является поводом к немедленной биопсии. ПСА повторяют в динамике, через несколько недель, в отсутствии провоцирующих его повышение факторов, иногда – после курса антибактериальной терапии. Имеет значение также скорость прироста уровня ПСА – вероятность наличия РПЖ возрастает при увеличении этого показателя > 1 нг/мл за год.
Индекс здоровья простаты
Актуальная практическая задача — изучение способа повышения специфичности маркеров РПЖ. В рекомендации по диагностике рака простаты на ранней стадии введено понятие индекса здоровья простаты (PHI-Prostate health index).
Его используют для принятия решения о целесообразности выполнения биопсии в сомнительных ситуациях, когда при ректальном исследовании не выявляется патология, а показатель общего ПСА определяется в «серой зоне» от 2,5 до 10 нг/мл.
PHI складывается из количественного определения общего, свободного ПСА и 2проПСА и их соотношения. Эти три величины объединены расчетной формулой. Чем выше индекс, тем больше вероятность обнаружения злокачественного процесса, и тем четче показания для биопсии. Пороговым значением PHI считается 25.
PCA3
В конце прошлого века был обнаружен РСА3 (Prostate Cancer Antigen 3). Это новый биомаркер, он более специфичен, чем общий и свободный ПСА, так как присутствует только в злокачественных клетках и не зависит от наличия доброкачественной аденомы, простатита, возраста.
Сейчас PCA3 повсеместно внедряется в практику. Выявляют его в моче, полученной после массажа предстательной железы. Анализ на РСА3 позволяет избежать ненужных биопсий.
Трансректальное ультразвуковое исследование (ТРУЗИ)
После очистительной клизмы в прямую кишку вводится ультразвуковой датчик. Таким образом, он будет максимально приближен к предстательной железе.
УЗИ картина рака простаты
Абсолютные признаки опухоли – это собственно визуализация очагового образования. Злокачественный узел чаще локализуется в одной доле органа, реже встречается двустороннее поражение.
Рак предстательной железы на УЗИ визуализируется как неправильной формы очаг с нечеткими краями, структура его – преимущественно гипоэхогенная с гиперэхогенными включениями.
В 1/3 случаев ТРУЗИ не визуализирует прямых признаков опухоли. Необходимо обращать внимание и на косвенные изменения: неровность поверхности железы, нарушение целостности капсулы, нечеткость контуров семенных пузырьков.
Биопсия
Это взятие ткани для микроскопического исследования. Является «золотым стандартом» в диагностике РПЖ. Она назначается при подозрении на опухоль по одному из трех базисных методов диагностики: пальцевом ректальном исследовании, ТРУЗИ и повышению (неоднократному) уровня ПСА.
Биопсия простаты проводится под местной анестезией под контролем трансректального УЗИ. Забор материала осуществляют толстой иглой, в который набирают столбик ткани высотой 15-20 мм.
Пункцию производят из 8-12 участков. Чем больше объем простаты, тем больше должно быть биопсийных точек.
Материал исследуется для определения наличия злокачественных клеток, гистологического типа опухоли, а также степени агрессивности по шкале Глисона.Данная шкала применима для аденокарцином, как наиболее распространенного типа опухолей ПЖ и включает в себя 5 степеней дифференцировки злокачественных клеток, пронумерованные соответственно по баллам от 1 до 5. Чем выше показатель, тем более низкодифференцированными клетками (а значит и более злокачественной опухолью) представлен образец.
Индекс Глисона – это сумма двух наиболее распространенных баллов в исследуемых биоптатах. Соответственно он может быть от 2 до 10. Эта цифра представляет прогностическую ценность, так как помогает предсказать скорость распространения рака, метастазирования, общую выживаемость, а также влияет на выбор тактики лечения.
| Индекс шкалы Глисона | Агрессивность рака |
| 2-4 | Низкая |
| 5-6 | Умеренная |
| 7 | Средняя |
| 8-10 | Высокая |
Если первичная биопсия не дала положительных результатов, а подозрения на наличие РПЖ сохраняются, выполняется повторная манипуляция. Особенно она показана при выявлении атипии и неоплазии в трех и более первично взятых биоптатов.
ТУР (трансуретральная резекция) не рекомендуется как целенаправленная процедура для диагностики рака простаты. Но резецированная ткань при проведении этой операции по поводу ДГПЖ обязательно направляется на гистологическое исследование и вполне может стать источником обнаружения злокачественных клеток.
Магнитно-резонансная томография (МРТ) малого таза
Данный метод позволяет определить размеры, распространенность опухоли, прорастание капсулы железы, поражение регионарных лимфоузлов и семенных пузырьков. На МРТ хорошо видны передние отделы простаты, которые недоступны пальпации через стенку прямой кишки и не всегда просматриваются при ТРУЗИ.
Определить стадию заболевания на дооперационном этапе можно только после МРТ. Это обследование обязательно при сумме Глисона > 7 и высоком уровне ПСА (> 20 нг/мл).
Компьютерная томография (КТ)
Преследует те же цели, что и МРТ, но считается менее информативной. Назначается при наличии противопоказаний к МРТ, а также при планировании лучевой терапии.
Для усиления результативности используется дополнительное контрастирование.
Лимфаденэктомия
Это операция, направленная на удаление тазовых лимфоузлов для уточнения их поражения. Проводится при планировании местного радикального лечения РПЖ в тех случаях, когда методы визуализации оставляют сомнения в наличии регионарных метастазов.
Пэт кт (позитронно-эмиссионная компьютерная томография)
Новейший метод радионуклидной и лучевой диагностики. Основные преимущества:
- Четкое установление первичного очага и распространенности его.
- Можно «просмотреть» сразу весь организм и визуаилизировать все метастазы (как местные, так и отдаленные).
- Информативность выше, чем у других методов визуализации. Обследование не инвазивно и безболезненно.
- Дает возможность контролировать результаты лечения.
В качестве радиоактивного маркера (или трейсера) используется холин-С11 или F18.
ПЭТ КТ не является пока рутинным методом исследования в силу своей малодоступности и высокой цены. Но в некоторых ситуациях она рекомендуется пациенту для выявления генерализации процесса.
Диагностика отдаленных метастазов
- РПЖ чаще других опухолей формирует отсевы в кости. Лучше всего их выявляет – остеосцинтиграфия. Метод, при котором радиоактивный технеций или стронций, введенный в кровь, имеет свойство интенсивно накапливаться в костных патологических очагах. Их выявляют путем последующего сканирования.
- Поражение костей редко бывает бессимптомным, поэтому это обследование не назначают при отсутствии болей в скелете, уровне ПСА< 10 и сумме Глисона < 6.
- Для исключения метастазов в легкие рекомендовано выполнение рентгенографии или КТ органов грудной клетки (всем пациентам, независимо от симптомов). КТ, в данном случае, более информативно.
- КТ или МРТ брюшной полости позволит визуализировать метастатические очаги в печень или другие органы.
- Если есть подозрение на поражение мозга (головные боли, судороги, выпадение функций), выполняется МРТ головного мозга.
Выводы
- Выявление изменений при пальцевом ректальном исследовании или повышение уровня ПСА могут указывать на РПЖ.
- Для уточнения диагноза проводится трансректальное УЗИ.
- Стадирование заболевание невозможно без МРТ или КТ малого таза.
- 100% достоверного неинвазивного диагностического теста на РПЖ нет.
- Точно установить или опровергнуть диагноз можно только после получения результатов биопсии, причем выполнение ее может быть многократным. Другие методы назначаются индивидуально.
- Нет единого мнения по скринингу РПЖ, большинство исследователей рекомендуют ежегодный анализ на ПСА мужчинам от 50 до 70 лет, а лицам с семейным анамнезом по этому заболеванию – с 40 лет.
Источник: https://RosOnco.ru/rak-predstatelnoj-zhelezy/diagnostika-rpzh
