Мутация в генах при раке молочной железы chek2
Содержание
Рак груди: как определить генетическую предрасположенность РМЖ

— Реклама —
Рак груди может встречаться в нескольких поколениях одной семьи: у бабушки, мамы и дочери диагностируется злокачественная опухоль. Такие формы рака называют наследственными, и по мере развития онкогенетики стала понятна причина их возникновения.
В 90-х годах прошлого века были открыты гены-онкосупрессоры, несущие информацию о белках, блокирующих процессы злокачественной трансформации клеток.
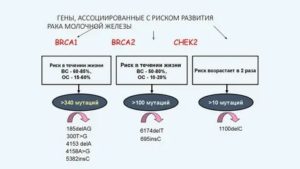
Сейчас науке известно множество генов с такой функцией: BRCA1, BRCA2, CHEK2, CDH1, PTEN, STK11, но наибольшее практические значение получили BRCA1 и BRCA2.
Что это за загадочные аббревиатуры: BRCA1 и BRCA2?
Это сокращение английского словосочетания Breast Сancer, которое переводится как рак груди. Мутации в генах BRCA1/BRCA2 – причина возникновения рака молочной железы у 5–10% женщин. Их роль в развитие онкологических процессов была открыта в 1994 году.
Гены BRCA1/BRCA2 кодируют белки, выполняющие в клетке функции супрессоров опухолевого роста. Они участвуют в восстановлении разрывов нитей молекул ДНК и участвуют в поддержании стабильности генома. Нарушение их работы ведет к нарастанию ошибок в ходе репарации ДНК.
На клетки с поврежденным генетическим материалом действуют белки-регуляторы клеточного цикла и «отправляют» их в апоптоз – программируемую клеточную гибель. Однако, ошибки репарации вызывают нестабильность клеточного генома, что, в свою очередь, приводит к инактивации белков-регуляторов.Результат – приобретение клеткой способности к бесконечному делению и отсутствие у нее реакции на механизмы контроля – ключевой момент онкогенеза.
В моей семье были случаи рака молочной железы. можно определить грозит ли мне наследственная форма рмж?
Да, можно. Для этого надо сдать генетический анализ в диагностической лаборатории.
У вас возьмут образец венозной крови или соскоб со слизистой щеки и с помощью методов молекулярной диагностики изучат генетический материал ваших клеток. Если мутация есть, то результат анализа будет положителен.
Однако тест рекомендуют проводить не всем людям, имеющим родственников с РМЖ. Основанием для назначения анализа здоровым женщинам служат следующие условия:
- двое и более ваших родственников болели раком груди, включая мужчин (отец, брат, дед);
- даже одному вашему родственнику диагноза РМЖ или рака яичников был поставлен ранее 40 лет;
- в вашей семье были случаи рака сразу обеих молочных желез;
- ваш возраст старше 20 лет.
У меня диагностирован рак молочной железы и врач рекомендовал сделать анализ на мутацию в генах brca1/brca2. зачем?
Как правило, врачи направляют на генетический анализ и пациенток с уже диагностированным раком груди. На первый взгляд кажется, что в анализе нет смысла, ведь рак уже возник. Однако информация о наличии или отсутствии мутации помогает онкологу спланировать лечение и подобрать оптимальную для каждой формы болезни терапию, так как у наследственного РМЖ есть свои особенности течения.
Показаниями для выполнения теста служат:
- злокачественная опухоль, возникшая в молодом возрасте (до 35 лет);
- тройной негативный РМЖ;
- развитие рака одновременно в груди и яичниках;
- множественные опухоли.
Результат анализа на мутации в генах BRCA1/BRCA2 положительный. Что это значит?
Положительный анализ означает, что вы носитель мутации, которая повышает индивидуальный риск развития РМЖ до 40–80%, а также рака яичников до 40%. Нарушения структуры генов могут быть переданы потомству любого пола с вероятностью 50%. Ваши родные братья и сестры также могут быть носителями этой мутации с вероятностью 50%.
У мужчин мутация в генах BRCA1/BRCA2 также повышает риск возникновения рака груди и предстательной железы.
Но это не значит, что у вас обязательно разовьется рак молочной железы или яичников. Носители мутации могут прожить с ней всю жизнь и не заболеть РМЖ.
Анализ показал наличие мутации. Что делать в этом случае?
Вы можете предпринять ряд мер, которые позволят в определенной степени контролировать процесс развития болезни.
- Носители мутации должны проходить регулярное обследование груди начиная с 20 лет. «Золотым стандартом» в этом случае будет – МРТ молочных желез с контрастированием и УЗИ. Важная деталь: обследования проводятся поочередно, интервал между ними – 6 месяцев. То есть, сначала выполняется МРТ, а через полгода УЗИ. После 40 лет добавляется ежегодная маммография.
- Наличие мутации также говорит о том, что внешние факторы, вызывающие рак, могут оказать на вас большее действие, чем у людей без нее. Поэтому особенно важно изменить свой образ жизни: следить за весом, избегать неоправданной гормонотерапии, избыточного пребывания на солнце, облучения грудной области. Интересно, что ранние роды – доказанный способ защиты от РМЖ, не эффективны при носительстве мутантного гена.
- Один из методов профилактики – превентивная химиотерапия – применение препаратов, блокирующих рецепторы эстрогена в молочной железе, и исключающих избыточное деление ее клеток под действием гормона.
- Самый радикальный способ профилактики наследственного рака груди – превентивное удаление здоровых молочных желез, а также яичников. Мнения врачей по поводу эффективности этого метода неоднозначны. Удаляя ткани железы, мы устраняем «субстрат» для развития раковой опухоли, но при этом наносим женщине сильную психологическую травму. К тому же операция не исключает возникновение рака на 100%.
Результат анализа на мутации в генах BRCA1/BRCA2 отрицательный. Это значит, что у меня не будет рака молочной железы?
Нет. Это значит, что вы не носитель мутантного аллеля, несмотря на то, что ваши ближайшие родственники болели раком груди. Ваш риск заболеть РМЖ не выше среднего в популяции и равен 3–10%. Но это не значит, что можно не посещать маммолога и не проходить регулярную маммографию после 40 лет.
Правда, следует помнить о ложноотрицательных результатах. Они маловероятны, но возможны.
Например, у женщины отягощенная наследственность по РМЖ и возникший в молодом возрасте рак груди, но анализ на мутации отрицательный. В этом случае возникают сомнения в точности полученных данных.
Такая ситуация становится возможной, если РМЖ возникает из-за пока некартированной и соответственно неопределяемой мутации.
К сожалению, мутация в генах, повышающая вероятность развития раковой опухоли, остается с человеком на всю жизнь. Но предупрежден, значит вооружен. Внимательное отношение к своему здоровью, изменение образа жизни и регулярные профилактические обследования позволят держать возникновение опухоли под контролем.
Анастасия Хомякова, врач-диагност
Иллюстрации: Юлия Прососова
Источник: https://www.vitajournal.ru/health/diagnostics/rak-grudi-predraspolozhennost-genetika/
BRCA мутация гена: анализ BRCA 1 и BRCA 2 на мутацию цена в Москве в Европейской клинике

Аббревиатурой BRCA обозначают два гена — BRCA1 и BRCA2. С английского языка их название переводится как «ген рака молочной железы» (BReast CAncer gene).
Несмотря на такое название, гены BRCA1 и BRCA2 сами по себе не приводят к раку. Они есть в клетках любого здорового человека и выполняют важные функции. Риск злокачественной опухоли повышается, когда функция этих генов нарушается из-за мутаций.
В норме белки, которые кодируют эти гены, нужны, чтобы восстанавливать поврежденную ДНК. Если в них возникают дефекты, то эта функция нарушается, поврежденная ДНК не восстанавливается должным образом, в клетке накапливаются генетические поломки, и она может превратиться в раковую.
По статистике, мутации в генах BRCA1 и BRCA2 встречаются у одного из 300–800 людей.
У носителей повышен риск рака молочной железы, яичников, фаллопиевых труб, брюшины, предстательной железы, поджелудочной железы, желудка, желчного пузыря и желчных протоков, меланомы.
Если человек наследует некоторые мутации от обоих родителей, у него развивается анемия Фанкони, повышается риск развития некоторых злокачественных опухолей и острого миелоидного лейкоза.
Какие функции выполняют гены BRCA1 и BRCA2 в норме?
Гены BRCA1 и BRCA2 находятся в разных хромосомах — соответственно в длинном плече (q) хромосомы 17 в положении 21.31 и в длинном плече (q) хромосомы 13 в положении 13.1. Но они выполняют схожие функции.
Расположение гена BRCA1. Источник: https://ghr.nlm.nih.gov/gene/BRCA1#location
Расположение гена BRCA2. Источник: https://ghr.nlm.nih.gov/gene/BRCA2#location
Оба белка, которые кодируются этими генами, устраняют двунитевые разрывы ДНК посредством гомологичной рекомбинации. Все хромосомы в клетках человека парные. Когда в одной из хромосом повреждены обе нити ДНК, сестринская хромосома «жертвует» ей одну цепочку аналогичного фрагмента своей ДНК, и по ней, как по шаблону, восстанавливается вторая цепочка.
Гены BRCA играют важную роль в этом процессе. Они являются генами-супрессорами опухолей. Если в них происходят мутации, геном становится нестабильным. Из-за накопившихся генетических дефектов нормальная клетка превращается в опухолевую и дает начало злокачественному новообразованию.
Как происходит мутация, и чем это грозит?
Все мутации в генах делят на две большие группы:
- Наследственные (герминальные) человек получает от родителей. Например, если у матери или у отца есть дефект в гене BRCA1 или BRCA2, ребенок получит его с вероятностью 50%, и он будет присутствовать во всех клетках тела. Мутация BRCA наследуется по аутосомно-доминантному типу, то есть достаточно, чтобы она присутствовала только в одной из парных хромосом. Даже если второй ген будет нормальным, функция белка нарушается, и это грозит повышенным риском рака.
- Соматические мутации возникают в течение жизни, например, из-за воздействия на организм ионизирующих излучений, химических канцерогенов. В этом случае генетический дефект возникнет только в некоторых клетках. И это тоже может привести к раку.
На данный момент известно множество разных видов мутаций в генах BRCA. Это могут быть делеции (потеря участка хромосомы), инсерции (лишние вставки в ДНК), однонуклеотидные полиморфизмы (замена отдельных «букв» генетического кода).
Насколько сильно повышается риск рака?
Рак молочной железы — самая распространенная «женская» злокачественная опухоль. По данным экспертов из США, это заболевание будет диагностировано в течение жизни у каждой восьмой женщины. У мужчин такая опухоль тоже может возникнуть, но риск намного ниже — 0,1% в течение жизни. При нарушенной функции генов BRCA риски существенно повышены.
При мутациях в BRCA1:
- Риск развития рака молочной железы у женщин к 70 годам: 44–78%.
- Риск развития рака молочной железы у мужчин к 70 годам: 0,22–2,8%.
При мутациях в BRCA2:
- Риск развития рака молочной железы у женщин к 70 годам: 31–56%.
- Риск развития рака молочной железы у мужчин к 70 годам: 3,2–12%.
Рак молочной железы, связанный с наследственными мутациями, составляет 5–10% от всех случаев. В 35% случаев за его развитие ответственны дефекты в гене BRCA1, в 25% случаев — в гене BRCA2.
Риск заболеть раком яичников в течение жизни для среднестатистической женщины составляет около 1,3%. При мутациях в гене BRCA1 он повышается до 18–54%, в гене BRCA2 — до 2,4–19%.
Кому нужно провериться на мутации BRCA?
Консультация клинического генетика и анализы на мутации в генах BRCA показаны в следующих случаях:
- Рак молочной железы у женщины выявлен в возрасте младше 50 лет.
- Злокачественные опухоли в обеих молочных железах.
- Трижды негативный рак молочной железы: по данным иммуногистохимического исследования, на поверхности опухолевых клеток отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2.
- Медуллярный рак молочной железы — редкий гистологический тип опухоли, по статистике часто бывает связан с мутациями.
- Первично-множественные злокачественные новообразования (ПМЗН) — когда у пациента диагностируют сразу две или более разных злокачественных опухолей. Чаще всего речь идет о раке молочной железы и яичников.
- Рак яичников, маточных труб, поражение злокачественными клетками брюшины в любом возрасте.
- Рак молочной железы у мужчины.
- Мутации в генах BRCA1 и BRCA2 особенно распространены в этнической группе евреев ашкенази, им рекомендуется провериться, даже когда нет других факторов риска.
Также рекомендуется проверяться людям, у которых отягощен семейный анамнез: если рак молочной железы был диагностирован у близкой родственницы до 50 лет, рак яичников в любом возрасте, двусторонние опухоли в молочной железе, первично-множественные злокачественные опухоли, если рак молочной железы диагностирован в любом возрасте у двух близких родственниц, у родственника-мужчины.
Наследование мутаций в генах BRCA. Розовым обозначены нормальные участки хромосом, белая — участок с мутацией. В данном случае носителем является отец, он передал «неправильный» ген одному из сыновей и одной из дочерей (50%). Двум другим детям (50%) достались нормальные гены. Источник
Если есть эти факторы риска, сначала логично проверить на мутации BRCA члена семьи, у которого был диагностирован рак. Затем проводят анализы на обнаруженные мутации у его близких родственников. Детям до 18 лет эти исследования не обязательны, потому что эффективных мер профилактики в детском возрасте не существует.
Зная о наличии мутации BRCA у онкологического больного, врач может назначить более эффективное лечение, правильно оценить прогноз. У здоровых людей эта информация помогает своевременно принять некоторые меры профилактики.
Как выявить мутации BRCA?
Для этого существуют специальные анализы. На исследование можно отправить образец крови (так называемая жидкая биопсия) или фрагмент злокачественной опухоли.
В крови можно обнаружить только наследственные мутации. Анализ опухолевой ткани позволяет выявить соматические мутации, которые произошли непосредственно в раковых клетках.
Поэтому зачастую рекомендуется отправлять в лабораторию и образец крови, и фрагмент ткани.Мутации выявляют разными способами, наиболее современный — метод секвенирования следующего поколения (Next-Generation Sequencing, NGS). Он позволяет выявить максимум разных генетических дефектов. Европейская клиника сотрудничает с ведущими зарубежными лабораториями, которые проводят такие исследования.
Что означает результат?
Если из лаборатории пришел положительный результат, это означает, что в опухолевых клетках есть мутация BRCA.
Если результат отрицательный, это еще не означает, что гены в клетке работают абсолютно нормально. Во-первых, мутации BRCA бывают очень разными.
Большинство из них можно выявить, но некоторые редкие не изучены, и анализы их не обнаруживают.
Во-вторых, даже если гены BRCA1 и BRCA2 имеют нормальную структуру, мутации, способствующие развитию рака, могут быть в других генах. Многие из них также можно обнаружить с помощью метода NGS.
Иногда результат бывает неопределенным. Это означает, что обнаружена некая мутация, но нет доказательств, что она повышает риск рака.
Если результат анализа на мутации BRCA отрицательный, но есть факторы, явно указывающие на то, что рак может быть наследственным, нужно снова проконсультироваться с клиническим генетиком. Врач решит, что делать дальше.
Что делать, если обнаружен генетический дефект? Можно ли снизить риск рака?
Женщины, у которых обнаружены мутации в генах BRCA1 и BRCA2, нуждаются в более тщательном наблюдении. Девушка должна уметь проводить самообследование молочной железы и с 18 лет делать это раз в месяц. С 25 лет рекомендуется ежегодно являться на осмотры к маммологу.
Кроме того, эксперты рекомендуют с 25 до 30 лет ежегодно проходить МРТ молочных желез, если ее невозможно выполнять — маммографию. С 30 лет показаны ежегодные маммографии и МРТ с контрастом.
Чтобы снизить риски, врач может предложить одну из двух мер:
- Профилактическое лечение тамоксифеном — гормональным препаратом, который блокирует эффекты эстрогенов.
- Профилактическое удаление молочных желез и/или яичников. После двусторонней мастэктомии риск рака молочной железы снижается на 90–95%.
Как лечат рак молочной железы с мутациями BRCA?
Наличие этих мутаций влияет на прогноз и выбор тактики лечения. У таких женщин повышен риск возникновения второй злокачественной опухоли в той же или другой молочной железе, поэтому зачастую хирурги рекомендуют двустороннюю мастэктомию, в то время как у пациентки без мутаций можно было бы обойтись органосохраняющей операцией.
Опухоли молочной железы с дефектами в генах BRCA1 и BRCA2 часто являются тройными негативными, то есть у них отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2. Такой рак сложнее лечить, против него неэффективны гормональные и некоторые таргетные препараты. Прогноз менее благоприятный.
Так как гены BRCA участвуют в репарации ДНК, то раковые клетки, в которых их функция нарушена, более чувствительны к химиопрепаратам, повреждающим ДНК, таким как цисплатин. Если опухолевые клетки имеют рецепторы к половым гормонам, они чувствительны к химиопрепаратам из группы таксанов.
Рост опухоли могут остановить ингибиторы PARP — препараты, которые нарушают восстановление поврежденной ДНК. В результате в раковых клетках накапливается еще больше мутаций, что и приводит к их гибели. К этой группе относятся препараты олапариб (Линпарза), рукапариб (Рубрака).
В Европейской клинике применяются наиболее современные анализы для выявления мутаций в генах BRCA1 и BRCA2, проводится лечение злокачественных опухолей в соответствии с современными международными протоколами. Мы знаем, как бороться с раком в сложных случаях. У нашего онколога вы можете получить консультацию, узнать о ваших рисках и о том, какие виды скрининга рекомендуется регулярно проходить в вашем случае.
Список литературы:
Источник: https://www.euroonco.ru/terms-from-a-z/mutatsii-v-genah-brca
Анти-HER2 терапия в лечении рака молочной железы
Процессы роста и размножения всех клеток в организме находятся под жестким регулирующим контролем генов, которые способных запускать или останавливать их.
В норме в организме поддерживается баланс между появлением новых клеток и гибелью старых. В опухолевых клетках процессы размножения клеток выходят из под контроля.
Зачастую это происходит по причине возникновения «сбоев» в работе определенных генов, играющих наиболее важную роль в контроле над делением клеток.
HER2 (аббревиатура от английского human epidermal growth factor receptor 2 – рецептор фактора роста эпидермиса) является одним из таких генов. Этот ген может также обозначаться как «HER2-neu» или «ERBB2», эти названия являются синонимами.
Его неправильная работа обнаруживается во многих случаях развития рака молочной железы и приводит к активной выработке в клетках одноименного белка (HER2), что заставляет клетки быстро делиться. Когда в клетке образуется избыточное количество белка HER2, говорят об амплификации этого гена. Амплификация HER2 обнаруживается примерно у 25% пациенток с диагнозом рака молочной железы.
Её наличие приводит к повышению агрессивности опухолевых клеток. Вследствие высокой важности знания HER2-статуса опухоли, определение наличия амплификации HER2 является или избыточной выработки белка HER2 является одним из стандартных методов обследования, и проводится у всех пациенток с диагнозом рака молочной железы.Кроме того, в ряде исследований была продемонстрирована клиническая значимость выработки HER2 при раке желудка, по этой причине препараты, подавляющие активность этого белка также применяются для лечения рака желудка.
В чем особенности HER2-положительного рака молочной железы?
Изначально HER2-позитивный рак молочной железы был одним из наиболее агрессивных разновидностей этого заболевания, который характеризовался очень быстрым темпом роста опухоли, высоким риском развития рецидива болезни и появления отдаленных метастазов.
Тем не менее, в настоящее время разработано множество препаратов, подавляющих активность этого белка (см. ниже).
Они продемонстрировали высокую эффективность в лечении HER2-положительного рака молочной железы, превратив этот подтип рака в один из относительно благоприятных вариантов заболевания.
Проведение целенаправленной («таргетной») терапии, блокирующей активность HER2, позволяет значительно повысить эффективность лечения и резко снизить риск развития рецидива рака молочной железы или добиться длительного контроля над болезнью в случае лечения её поздних стадий.
Кому назначаются препараты, блокирующие активность HER2?
Необходимо отметить, что применение препаратов, блокирующих активность HER2, целесообразно только в том случае, если в опухоли есть повышенная выработка этого белка вследствие наличия амплификации гена HER2.
Если она отсутствует, раковые клетки не вырабатывают этот белок, следовательно, назначение препаратов, блокирующих активность этого белка не приведет к желаемому результату.
По этой причине перед началом лечения всем пациенткам с диагнозом рака молочной железы перед началом лечения проводится специальное обследование, направленное на определение повышенной выработки HER2. Эта информация критически важна для правильного лечения рака молочной железы.
Как определяется HER2 статус опухоли?
В процессе диагностики рака молочной железы небольшой кусочек опухолевой ткани путем биопсии забирается для проведения иммуногистохимического исследования.
Как правило, одновременно проводится определение наличия экспрессии (выработки) опухолевыми клетками рецепторов женских половых гормонов, HER2-статуса опухолевых клеток, а также темпов её роста (индекс Ki-67).
При проведении этого исследования на опухолевые клетки наносятся специальные «красители», которые окрашивают HER2 в случаях, когда он содержится в клетках в большом количестве. Иммуногистохимическое исследование оценивает наличие гиперпродукции белка HER2 опухолевыми клетками.
По результатам иммуногистохимического определения HER2 статуса опухоли может быть получен один из следующих результатов:
0 баллов – в опухоли не отмечено признаков экспрессии HER2 (результат исследования отрицательный, назначение анти-HER2 препаратов нецелесообразно);
1+ — в опухолевых клетках обнаружена незначительная экспрессия HER2 (результат исследования отрицательный);
2+ — в опухолевых клетках обнаружена умеренная экспрессия HER2 (результат сомнительный, требуется проведение дополнительного исследования, см. ниже);
3+ — в опухолевых клетках обнаружена повышенная экспрессия HER2 (результат положительный, назначение анти-HER2 препаратов целесообразно).
Если по результатам иммуногистохимического исследования была выявлена выраженная экспрессия HER2 (3+), пациентке показано назначение препаратов, блокирующих активность этого белка, так как опухолевые клетки активно вырабатывают этот белок и процессы их роста зависят от его функционирования. Если результат исследования отрицательный (0 или 1+) назначение такого лечения не приведет к желаемому результату.
Получение сомнительного результата (2+) означает, что по результатам иммуногистохимического исследования достоверно определить наличие экспрессии HER2 не удалось и необходимо проведение дополнительных методов исследования, например, т.н.
«флюоресцентной гибридизации in situ» (FISH) или схожего с ней метода CISH. Эти методы позволяют напрямую оценить наличие амплификации HER2. По результатам проведения этих тестов может быть получен положительный или отрицательный ответ.Положительный ответ означает, что была выявлена амплификации HER2 и целесообразно назначение анти-HER2 терапии.
Какие существуют лекарственные препараты для лечения HER2-позитивного рака молочной железы?
На данный момент разработано и внедрено в клиническую практику 4 препарата, подавляющих активность HER2.
Они несколько различаются по структуре и механизму действия, а также по показаниям к применению, эти лекарства могут назначаться как в комбинации с другими препаратами, например химиотерапевтическими агентами, так и самостоятельно (в монотерапии). В этом разделе представлено краткое описание этих препаратов.
Трастузумаб – лекарственный препарат, который представляет собой белок (моноклональное антитело), сконструированный таким образом, чтобы избирательно связываться с HER2 и «закрывать» его, не давая ему возможности нормально функционировать и провоцировать процессы роста и деления опухолевых клеток.
Трастузумаб является препаратом, который наиболее часто назначается пациенткам с HER2-положительным раком молочной железы. Он применяется в сочетании с химиотерапией в качестве пред- или послеоперационной терапии данного заболевания, а также для первоначального лечения поздних его поздних стадий.
Препарат выпускается как в виде раствора для внутривенных капельных введений, так и в виде раствора для подкожных введений.
Трастузумаб-эмтанзин (T-DM1) – комбинированный препарат, который содержит молекулы трастузумаба, соединенные с противоопухолевым препаратом эмтанзином, который оказывает губительное действие на клетки.
Препарат сконструирован таким образом, что молекулы трастузумаба связываются со своей мишенью на поверхности опухолевых клеток, после чего эмтанзин проникает в них и вызывает гибель раковых клеток. Помимо лечения рака молочной железы трастузумаб также применяется для лечения рака желудка в случае выявления в опухоли гиперэкспрессии HER2. Препарат вводится внутривенно капельно.
Пертузумаб – также как и трастузумаб, пертузумаб представляет собой моноклональное антитело к HER2, однако в отличие от трастузумаба он связывается с другим участком этого белка. Препарат назначается в комбинации с трастузумабом и позволяет повысить эффективность лечения. Препарат вводится внутривенно капельно.
Лапатиниб – препарат, блокирующий сигнальный путь, который проводит сигналы от HER2.
Препарат применяется для лечения пациенток, у которых было отмечено прогрессирование на фоне применения режимов лечения с использованием трастузумаба, а также для лечения HER2-положительного гормонозависимого рака молочной железы, в этом случае лапатиниб применяется в комбинации с гормонотерапией. Препарат выпускается в виде таблеток и принимается внутрь.
Указанные препараты назначаются только пациенткам с HER2-положительными опухолями (экспрессия HER2 3+ при проведении иммуногистохимического исследования или выявленная амплификация гена при проведении FISH или схожего метода исследования).
Может ли HER2 статус изменяться в процессе проведения лечения?
Необходимо отметить, что HER2 статус опухоли может меняться в процессе проведения лечения как результат изменений, происходящих в раковых клетках. Клетки опухоли ищут способ выжить на фоне проводимой терапии и постоянно изменяются.
Например, в случае, если произошел рецидив исходно HER2-положительной опухоли, во вновь выявленных опухолевых очагах может отмечаться исчезновение выработки этого белка и утрата зависимости опухолевых клеток от влияния этого гена. Возможно и обратное – появление гиперэкспрессии HER2 в опухолях, которые исходно не вырабатывали этот белок.
По этой причине в случае развития рецидивов или появления метастазов врач может рекомендовать повторное проведение биопсии и проведение нового тестирования для определения HER2 статуса опухоли.
Источник:
- BreastCancer.org. HER2 Status.
Источник: https://www.russcpa.ru/patsientam/o-rake/anti-her2-terapiya-v-lechenii-raka-molochnoy-zhelezy/
Тестирование HER2-статуса рака молочной железы. Что такое her2/neu 0, 1+, 2+, 3+ и как это отразится на вашем лечении

Современная диагностика рака молочной железы в обязательном порядке предусматривает тестирование HER2-статуса опухоли. HER2 (англ.
human epidermal growth factor receptor 2; рецептор эпидермального фактора роста, тип 2) – это белок, который играет важную роль в патогенезе и прогрессировании определённых подтипов рака молочной железы.
Другими словами, если клетки раковой опухоли молочной железы содержат избыточное количество белка HER2, то это заставляет её быстрее расти, способствует раннему метастазированию.
HER2 является важным биомаркером и терапевтической мишенью рака молочной железы. Знание того, какой у вас рак молочной железы (HER2-позитивный или HER2-негативный), помогает врачу определиться с наиболее эффективным лечением.
Позитивный статус HER2 свидетельствуют о том (иммуногистохимия – her2/neu 3+ или FISH – результат положительный), что опухоль чувствительна к препаратам таргетной терапии (например, к Герцептину).
Кроме того, анализ на HER2 и другие онкомаркеры рака молочной железы дают возможность предугадать поведение онкологического заболевания – определить степень риска возникновения рецидивов и раннего метастазирования.
Это помогает выбрать адекватную стратегию лечения.
Что такое HER2-статус?
HER2 белок присутствует на поверхности как нормальных клеток молочной железы, так и злокачественных. Ген (он обозначается как HER2 или ERBB2) содержит инструкцию, как синтезировать этот белок.
Каждая клетка содержит две копии гена. Однако возможен вариант появления дополнительных копий (амплификации гена HER2, англ.
HER2 amplification), в результате чего появляется избыток HER2-рецепторов на поверхности клетки (гиперэкспрессия HER2, англ. HER2 overexpression).
Этот белок содержат все клетки, однако на клетках HER2-позитивного рака молочной его находится слишком много (показатель может превышать норму в 100 раз).Чем больше рецепторов, тем больше факторов роста присоединяться к поверхности злокачественной клетки. Дополнительные сигналы заставляют клетки чаще делиться. Результат – опухоль становится более агрессивной (быстро растет, рано дает метастазы).
Узнайте больше: Трижды позитивный рак молочной железы ((эстроген- (ER+), прогестерон- (PR+) и HER2-положительный))
Почему важно знать HER2-статус опухоли молочной железы?
Определение HER2-статуса важно в нескольких аспектах:
- HER2-положительный рак молочной железы ассоциирован с худшим прогнозом (высокий риск рецидива);
- этот рак хорошо отвечает на химиотерапию, в частности на терапию антрациклинами (доксорубицин, эпирубицин), и относительно резистентен к гормонотерапии;
- знание HER2-статуса позволяет определиться с чувствительностью опухоли к препаратам таргетной терапии.
Узнайте больше: Когда назначается таргетная терапия при раке молочной железы?
На сегодняшний день доступны следующие анти-HER2-препараты – лекарства, подавляющие активность этого белка:
- Герцептин/Herceptin (трастузумаб)
- Перьета/Perjeta (пертузумаб)
- Тайверб/Tykerb (лапатиниб)
- Нерлинкс/Nerlynx (нератиниб)
Также значительную помощь оказывает точное знание того, какой HER2-статус у вторичной опухоли (метастаза), что важно при лечении метастатического HER2-положительного рака молочной железы.
HER2-позитивные опухоли молочной железы выявляются у каждой четвертой пациентки. Совсем недавно такой диагноз ассоциировался с неблагоприятным прогнозом. Появление в арсенале онкологов препаратов таргетной терапии позволило существенно улучшить прогноз HER2-положительного рака молочной железы.
Узнайте больше: Поставлен диагноз «рак груди»: обследование, которое назначается перед началом, в период активного лечения и после
Кому показан анализ на her2 при раке молочной железы?
Каждой женщине, у которой подтвержден диагноз «инвазивный (инфильтрирующий) рак молочной железы», необходимо проверить HER2-статус опухоли.
«Инвазивный» означает рак молочной железы 1, 2, 3 и 4 стадий. Стадии 0 или карцинома in situ) считается «неинвазивной».
Все стадии рака молочной железы, начиная с первой по четвёртую, должны быть проверены на статус HER2 перед началом лечения.
Повторное тестирование
Возможна ситуация, когда потребуется повторное тестирование, например:
- Рецидив заболевания, будь то местный, региональный или появились отдаленные метастазы.
- Если при метастатическом раке выявлены новые метастазы (прогрессирование заболевания).
- Если вы и ваш онколог считаете, что необходимо провести тестирование HER2-статуса с помощью другого метода.
Методы определения HER2-статуса
Для анализа используется кусочек ткани опухоли, полученных во время биопсии или операции. Кроме того, для анализа может быть использован архивный образец ткани (парафиновые блоки). Для определения HER2-статуса применяется два метода:
- Иммуногистохимия HER2 (ИГХ, англ. IHC): определение количества белка HER2 на клеточной поверхности (повышенная экспрессия HER2).
- Гибридизация in situ (ISH): определение количества копий гена HER2 (амплификации гена HER2). Существует две методики гибридизация in situ: флуоресцентная гибридизация in situ (FISH) и ISH с использованием наборов PathVysion (выполняется с помощью обычного микроскопа в светлом поле).
Иммуногистохимия, как правило, дешевле. Тестирование проводится быстро, поэтому иммуногистохимия используется чаще. FISH, однако, считается более точным исследованием. Чаще его используют в качестве дополнения к иммуногистохимическому исследованию, если точность результата последнего вызывает сомнение.
Расшифровка результатов тестирования HER2-cтатуса рака молочной железы
Хотя IHC и ISH предназначены для определения одного и того же параметра, их результаты описываются по-разному.
Вот, что вы можете прочитать в заключение после проведения иммуногистохимического исследования на HER2:
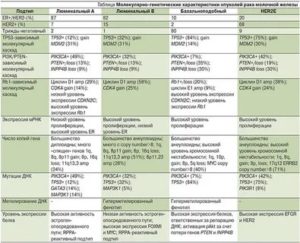
| Результаты ИГХ | Статус гиперэкспрессии HER2 |
| her2/neu 0 | Отрицательный |
| her2/neu 1+ | Отрицательный |
| her2/neu 2+ | Пограничный (неопределенный) |
| her2/neu 3+ | Положительный |
Как упоминалось выше, определение HER2-статуса опухоли методом FISH является более точным, хотя возможна двусмысленность трактовки полученного результата.
| Результаты FISH | Статус гиперэкспрессии HER2 |
| Позитивный | Выявляется амплификация гена HER2 |
| Негативный | Нет амплификации гена HER2 |
В соответствии с рекомендациями ASCO / CAP 2013 года, если HER2-статус расценивается как неопределенный по IHC 2+, то необходимо проведение дополнительного исследования методом ISH для определения амплификации гена HER. Неопределенный HER2-статус по ISH (HER2/CEP17 1,8—2,2) требует анализа дополнительного количества ядер опухолевых клеток (не менее 40) или повторения IHC и ISH.
Положительные результаты исследований IHC (3+) и FISH (есть амплификация гена HER2) означают, что вам будет рекомендован препарат таргетной терапии, который будет подавлять размножение клеток HER2-позитивного рака молочной железы.
Ограничения
Вы узнали, почему необходимо тестирование HER2 статуса, но также важно знать и о его недостатках:
- Неточность (ошибки): порой результаты тестирования бывают неубедительными. Поэтому может потребоваться дополнительное тестирование образца ткани, взятого из другого участка опухоли.
- Гетерогенность: Возможна такая ситуация: одни участки опухоли дают HER2-положительный результат, а другие HER2-отрицательный.
- Изменение статуса: опухоль может поменять свой HER2-статус, поэтому результаты, который был перед началом лечения, может не соответствовать результатам, которые вы получите в последующем.
Изменение HER2-статуса
Многие думают, что злокачественная опухоль состоит только из клеток потомков одной мутантной клетки. Но это не так, клетки опухоли продолжают накапливать новые мутации.
Различные участки одной опухолевой массы могут содержать клетки с различными характеристиками (гетерогенность опухоли), и эти отличия могут стать еще более очевидными, когда опухоль прогрессирует, например, при рецидиве или метастазировании.
По этой причине может измениться не только HER2-статус, но и статус рецептора эстрогена (ER) и рецептора прогестерона (PR). Это можно наблюдать при рецидиве заболевания или когда прогрессирует метастатический рак груди. Такое изменение рецепторного статуса называется диссонансом. Опухоль может изменить свой статус с позитивного на негативный по одному из этих рецепторов или наоборот.
Вероятность несоответствия по рецептурному статусу исходной опухоли и первого или второго метастазов:
| Статус | Вероятность изменения статуса |
| HER2 | 19.6 % |
| ER | 20.7 % |
| PR | 40.7 % |
В одном исследовании (2016 года) было установлено, что почти 20% опухолей изменили свой статус с HER2-позитивного на HER2-негативный или наоборот. Знание этого, очень важно при выборе оптимального варианта лечения.
Кроме того, в этом исследовании установлен следующий факт – опухоли, которые не соответствовали своему первоначальному HER2-статусу (на положительный или отрицательный), имели такой же прогноз, как и те, которые этот статус не поменяли.
Это исследование обнаружило несоответствие между исходными метастазами и первым или вторым метастазом, но также может возникнуть несоответствие между первым и вторым метастазами.
Ошибочный диагноз
Если ваша опухоль на самом деле HER2-положительная, но вы получаете HER2-негативный результат, то вы рискуете не получить лечение, которое может улучшить выживаемость. С другой стороны, если ваш HER2-статус в действительности отрицательный, но вы получаете положительный результат статуса, вы подвергаетесь риску получения побочных эффектов, связанных с анти-HER2 таргетной терапией.
Несколько слов от OncoInfo
До проведения какого-либо лечения (за исключением случаев хирургического удаления опухоли) инвазивный (от стадии I до стадии IV) рак молочной железы должен быть протестирован на наличие HER2-рецепторы, а также определен статус рецепторов эстрогена и прогестерона.
Тестирование также следует повторить, если у вас был тест, который вернулся как неопределенный, если ваш онколог считает, что необходима другая методика определения HER2-статуса, а также при рецидиве заболевания. Со временем опухоль может поменять свой HER2-статус.
Статья по теме: HER2-позитивный рак молочной железы — это хорошо или плохо?
Список использованных источников:
Источник: https://oncoinfo.site/2020/04/13/her2-i-rak-molochnoj-zhelezy/
Анализ дозы гена HER2/neu при раке молочной железы (РМЖ)
Рак молочной железы представляет собой наиболее распространенную форму онкологической патологии у женщин.
Заболеваемость раком молочной железы в России на конец 2011 года составила 45,2 случая на 100 тысяч женщин, занимая 20,4 % в структуре общей онкологической заболеваемости. Ежегодно в России выявляется более 57 тыс. новых случаев РМЖ.
Корректный выбор пре- и постоперационной терапии, прогноз развития опухоли, оценка вероятности рецидива во многом опираются на исследование прогностических и предсказательных маркёров.
Что такое HER2?
Рецептор HER2 − один из наиболее значимых молекулярных маркёров при раке молочной железы (РМЖ). В нормальном состоянии рецептор HER2 располагается на поверхности многих клеток организма.
Примерно у каждой четвертой женщины, больной РМЖ, количество этого белка в клетках опухоли повышено по сравнению с нормой. В основе увеличенной экспрессии лежит амплификация гена HER2/neu.
Избыточное количество этого рецептора на поверхности раковых клеток свидетельствует о высокоагрессивной форме РМЖ.
Что такое высокоагрессивная форма РМЖ?
Злокачественное новообразование в молочной железе с амплификацией и увеличенной экспрессией гена HER2/neu. Опухоль данного типа ведет себя крайне агрессивно и быстро метастазирует в другие органы. Больные РМЖ с положительным HER2-статусом имеют плохой прогноз и низкую выживаемость (1-2 года с момента постановки диагноза). Заболеванию подвержены женщины в репродуктивном возрасте.
Опухоль с положительным HER2-статусом не реагирует на традиционные линии химиотерапии.
Количество больных РМЖ с HER2-положительным статусом: HER2-положительный статус опухоли выявляется у 25-30% всех пациентов с РМЖ (около 15 тыс. новых случаев в год). В России около 90 000 тыс. женщин с РМЖ с положительным HER2-статусом. Из них выявлено и состоит на учете только 3 425 пациенток.
Кто должен пройти процедуру обследования?
Все женщины с выявленным РМЖ должны пройти проверку на определение HER2-статуса в клетках опухоли, поскольку этот статус крайне важен как для прогноза, так и для подбора адекватного лечения.
Проверка статуса позволяет врачу с большей точностью определить, к какому из типов рака относится данная конкретная опухоль, уточнить диагноз и подобрать в индивидуальном порядке наиболее подходящее лечение.
На сегодняшний день анализ дозы гена HER2/neu при метастатическом раке молочной железы рекомендован Европейским обществом онкологов как необходимый элемент исследования больного.
Почему важно знать HER2-статус опухоли РМЖ?
Положительный HER2-статус опухоли важен сразу с нескольких точек зрения:• Позволяет врачу оценить склонность опухоли к прогрессированию;
• Определить реакцию организма на предложенное лечение.
Показано, что для пациентов с положительным HER2-статусом опухолей при химиотерапии неэффективно использование Метатрексата и Тамоксифена, а использование антрациклинов и платиносодержащих препаратов наоборот более эффективно, таксаны и ингибиторы ароматазы одинаково эффективны, вне зависимости от HER2-статуса опухоли. Анализ дозы гена HER2 позволяет узнать, имеет ли смысл назначать лечение Герцептином.
Что такое Герцептин?
Герцептин (Roche, Швейцария) является ярким представителем класса таргетных препаратов, на основе моноклональных антител, которые с высокойстепенью избирательности связываются с внеклеточной частью рецептора HER2.
Благодаря этому действию поражение раковых клеток становится более направленным, адресным и щадящим по отношению к здоровым клеткам организма. После того как Герцептин блокирует HER2-рецепторы на поверхности раковой клетки, ее дальнейший рост прекращается и в ряде случаев наблюдается уменьшение опухоли.
Кроме прямого антипролиферативного действия Герцептин способен вызывать уничтожение опухолевых клеток за счет реакции антитело-зависимой клеточной цитотоксичности.
Использование Герцептина позволяет увеличить время до прогрессирования и общую выживаемость больных с гиперэкспрессией HER2/neu, преодолеть резистентность опухоли к цитостатическим препаратам и уменьшить дозу химиотерапии, и, как следствие, дает шанс продлить отпущенные болезнью годы жизни.
Установление HER2 статуса
В подавляющем большинстве случаев в основе увеличенной экспрессии лежит амплификация гена HER2/neu, для определения HER2-статуса опухоли мы предлагаем анализ дозы гена HER2/neu в клетках опухоли с помощью ПЦР в реальном времени.
Данная технология имеет хорошую корреляцию с иммуногистохимическим (ИГХ) методом диагностики HER2-статуса опухолей (1).
Кроме того, ПЦР в реальном времени является прекрасной альтернативой тест-системы на основе флуоресцентной гибридизации in situ (FISH), которая была рекомендована Управлением по контролю за качеством пищевых продуктов и лекарственных средств (США) как стандартный метод диагностики HER2-статуса опухолей при прогнозировании течения РМЖ (2, 3).
Материал для исследования
Для анализа используется ДНК из ткани опухоли РМЖ, полученных во время биопсии или операции. Кроме того, для анализа может быть использована ДНК, выделенная из архивных образцов ткани опухоли РМЖ заключенных в парафиновые блоки.
Источник: https://biolinklab.ru/analiz-dozy-gena-her2neu-pri-rake-molochnoj-zhelezy-rmzh/
Мутации генов при раке

Причина и следствие. Мутации генов при раке лежат в основе возникновения опухоли и являются причиной неблагоприятных исходов болезни, но знание генных нарушений помогает выбрать оптимальный вариант терапии.
Для начала надо четко понимать: главная причина появления предраковых и опухолевых клеток – мутации генов при раке. Реже генетические нарушения передаются по наследству, чаще это следствие длительного действия канцерогенных факторов (приобретенные генные нарушения).
Наличие каких-либо врожденных или приобретенных мутаций вовсе не означает, что злокачественное новообразование обязательно будет, но если имеются онкогенные дефекты в ДНК, то риск онкологии очень высок (особенно, если плохая наследственность сочетается с негативным влиянием внешних канцерогенов).
Чаще всего мутации генов при раке влияют на возникновение нескольких видов злокачественных новообразований. Например, нарушения в генах BRCA1 и BRCA2 с высокой степенью вероятностью могут стать причиной для возникновения рака молочных желез и/или яичников.
Молекулярный профиль опухолевой ткани
Для многих видов карцином, помимо определения гистотипа опухоли, необходимо проводить иммуногистохимические и молекулярно-генетические исследования, с помощью которых можно выявить конкретные и важные мутации генов при раке. Эти обследования являются обязательными при следующих часто встречающихся видах злокачественных новообразований:
· Рак молочной железы;
· Опухоль в яичниках;
· Колоректальная карцинома;
· Рак легкого;
· Меланома;
· Рак щитовидной железы.
В частности, при меланоме, опухоли в легких и раке толстой кишки важный элемент исследований – определение генных мутаций EGFR (рецептор эпидермального фактора роста, через который проходит стимуляция клеточных структур тканей, заставляющая их многократно делиться, видоизменяться и приобретать типичные свойства раковых клеток). На внутриклеточном уровне передачу этих стимулов обеспечивают специальные белковые молекулы (BRAF, CRAF, KRAS и другие).
Чаще всего выявляется мутация BRAF (до 90% всех молекулярно-генетических нарушений при опухолях): по сути, это генетическое изменение является одной из причин для пролиферации ткани, появления предраковых и раковых клеток.
Даже при наличии дефектов ДНК любая клетка способна самовосстанавливаться (для этого природа создала гены, ремонтирующие повреждения).
Однако даже если один из этих генов-ремонтников мутирован, то это ухудшает ситуацию, создавая условия для злокачественного перерождения нормальных клеток (дефекты ДНК при каждом делении не ремонтируются, накапливаются и – мутантные клетки начинают свой путь к раковым изменениям).
Еще один важный молекулярно-генетический фактор – MSI (накопление дефектов в ДНК). Выделяют 2 варианта результатов обследования:· MSI-H (microsatellite instability high – высокий уровень нестабильности в коротких участках (микросателлитах) ДНК)
· MSS (microsatellite stability – микросателлитная стабильность).
В первом случае результат исследования указывает на наличие нарастающих ДНК-дефектов внутри клеток. Во втором – на определенную стабильность в генах, что вовсе не означает, что это хорошо (очень много генных повреждений).
Мутации генов при раке: зачем их определять?
Подходим к главному – зачем врачу-онкологу знать молекулярно-генетический статус опухоли?
При колоректальном раке само по себе наличие мутации BRAF и MSI-H является прогностически неблагоприятным фактором (высокий риск опухолевой прогрессии), но карцинома с этими генетическими нарушениями очень хорошо реагирует на индивидуально подобранную иммунотерапию, которая оказывает положительный лечебный эффект даже при метастатических формах рака кишечника.
При злокачественных опухолях легких важно знать гистотип новообразования (до 70% плоскоклеточный рак, около 30% — карцинома с генными мутациями).
Первый вариант возникает на фоне действия внешних канцерогенов, хуже поддается терапии и прогностически неблагоприятен, второй – наследственная форма рака, при которой можно подобрать таргетные препараты и создать условия для перехода в стойкую ремиссию.
Итак, ответ на вопрос — зачем знать, есть ли мутации генов при раке?
Знание молекулярной биологии раковых клеток помогает бороться с опухолью. В частности, определение мутации BRAF и MS-статуса при некоторых видах злокачественных новообразований является основой для успешного применения методов биотерапии рака.
Вне зависимости от причин, все патологические изменения в ДНК происходят на микроскопическом уровне. В последние десятилетия медицинская наука (молекулярная биология, генетика, фармакология) прошла большой путь, став основой для понимания процесса злокачественного перерождения нормальных клеток организма.
И самое главное, наука помогла найти новые способы лечения в онкологии. В частности, таргетная терапия основана на прицельном воздействии на молекулярно-биологические особенности каждой конкретной опухоли (BRAF и MSI – это только верхушка айсберга, молекулярных маркеров в опухолях очень много).
И чем больше будет найдено мишеней на молекулярном уровне, тем эффективнее будет стрельба по хитрым и шустрым онкоклеткам.
на сайте parashistay.ru
Источник: https://zen.yandex.ru/media/onkos/mutacii-genov-pri-rake-5ec7c48f66373444fde4c418
